Новые возможности профилактики гемокаогуляционных осложнений
Обследовано 160 пациентов, которым выполнено эндопротезирование тазобедренного, коленного, плечевого и локтевого суставов. В группе наблюдения (n = 80) за 30 минут до начала операции и через 4 часа после ее окончания вводился Транексам по 250 мг внутривенно. Через 10-12 часов после окончания операции (наступление устойчивого гемостаза) все пациенты этой группы получали таблетки Прадакса в дозе 220 мг с последующим его применением 1 раз в сут. по 220 мг. В группе сравнения (n = 80) за 12 часов до операции вводился Фраксипарин, подкожно 0,3-0,4 мл, с последующим введением по 1 разу в сут. в послеоперационный период. Определяли объем интраоперационной, и послеоперационной кровопотери, а также динамику гематологических показателей. Оценивали общее количество тромбоэмболических осложнений. Кроме того, в группе наблюдения дренирование раны осуществлялось системой CellTrans с последующей реинфузией крови, а в группе сравнения дренирование раны выполнялось обычными пхв дренажами с активной аспирацией содержимого, без реинфузии крови. Установлено, что комплексное применение в раннем послеоперационном периоде транексановой кислоты, Прадаксы, а также дренирования раны системами CellTrans с послеоперационной реинфузией крови позволило более чем на 40 % сократить объем кровопотери на всех этапах исследования; общая кровопотеря составила в группе наблюдения 585,4 ± 124,2 мл, в группе сравнения - 959,8 ± 178.3 мл. Предложенный подход является эффективным и безопасным средством профилактики тромбоэмболических осложнений и кровотечений в раннем послеоперационном периоде после операций эндопротезирования крупных суставов.
NEW OPPORTUNITIES FOR PREVENTION OF CLOTTING COMPLICATIONS AFTER ARTHROPLASTY OF LARGE JOINTS
A.B. Slobodskoy, A.V. Kuligin, A.Yu. Bogorodskiy, E.Yu. Osintsev, A.G. Lezhnyov, I.V. Voronin,1.S. Badak, A.G. Dunaev, V.V. Ruban
Abstract 160 patients who underwent the endoprosthesis replacement of coxofemoral, knee, humeral and elbow joints are examined. In study group (n = 80) in 30 minutes prior to operation and in 4 hours after its completion Tranexam was entered on 250 mg intravenously. In 10-12 hours after the end of operation (onset of stabile hemostasis) all patients of this group received Pradaxa on 220 mg with the subsequent its application ofl times in day on 220 mg. In control group (n -SO) in 12 hours prior to operation Fraxiparine was entered (hypodermically with 0,3-0,4 ml with the subsequent intake on 1 time in day during the postoperative period). The volume of intraoperative and postoperative blood loss, as well as dynamics of hematologic indicators are determined. The total of the thromboembolic complications are estimated. Besides, in study group the wound drainage was carried out by CellTrans system from the subsequent refusion of blood, and in control group the wound drainage was carried out by usual PVC by drainages with active aspiration of contents, without refusion of blood. It is established that complex application in the early postoperative period of tranexamic acid, Pradaxa and also the wound drainage by CellTrans systems with the postoperative refusion of blood allowed more than 40% reduction in the volume of blood loss at all investigation phases; the general blood loss in study group made 585,4 ±124,2 ml, in control group it made 959,8 ±178.3 ml. The offered approach is an effective and safe prophylactic of the thromboembolic complications and bleedings in the early postoperative period after operations of endoprosthesis replacement of large joints.
Введение
Операции эндопротезирования крупных суставов относятся к сложным реконструктивным вмешательствам, которые позволяют эффективно восстанавливать нарушенные функции опорно-двигательного аппарата и заметно улучшать качество жизни пациентов [5, 6]. Однако, учитывая тяжесть данных операций, для них характерна высокая частота тромбэмболических осложнений и других нарушений гемостаза. По данным разных авторов, тромбоэмболические осложнения при операциях эндопротезирования крупных суставов могут достигать 20 %, общая кровопотеря составляет от 10 до 30 % ОЦК, а при сложных и обширных вмешательствах может достигать 50 % и более ОЦК [1, 3, 7, 8]. В связи со значительным увеличением числа операций эндопротезирования суставов, необходимость профилактики тромбоэмболических осложнений и кровотечений в ранний послеоперационный период становится все более актуальной [2, 4, 9, 10].
Отсутствие единого комплексного подхода к методам профилактики тромбоэмболических осложнений и кровотечений при операциях эндопротезирования крупных суставов диктуют необходимость проведения данного исследования.
Цель исследования
Оценить эффективность и безопасность комплексного подхода к профилактике тромбоэмболических осложнений и кровотечений при операциях эндопротезирования крупных суставов в раннем послеоперационном периоде.
Материалы и методы
В исследование включено 160 пациентов, лечившихся в ортопедическом отделении ОКБ г. Саратова в период 2010-20014 гг. Из них эндопротезирование тазобедренного сустава выполнено 38 пациентам, коленного сустава - 42, плечевого сустава - 36 и локтевого сустава - 44 больным. Возраст пациентов - от 34 до 85 лет. Средний возраст - 64,7±7,7 лет. Мужчин - 54, женщин - 106. Масса тела больных от 49 до 117 кг. Группу наблюдения (n = 80), составили пациенты, которым за 30 минут до начала операции и через 4 часа после ее окончания вводился ингибитор фибринолиза - ингибитор перехода плазминогена в плазмин -транексамовая кислота в дозе по 250 мг. Через 10-12 часов после окончания операции (наступление устойчивого гемостаза), все пациенты этой группы получали антикоагулянт - Прадакса (дабигатрана этексилата мезилат), который является прямым ингибитором тромбина в дозе 220 мг, с последующим его применением в этой же дозировке 1 раз в сут. по 220 мг. В группе наблюдения всем больным поводилось дренирование раны специальной системой CellTrans, с возможностью последующей реинфузии аутокрови. В группу сравнения (п = 80) вошли пациенты, которым за 12 часов до операции и через 12 часов после операции водился антикоагулянт прямого действия Фраксипарин (надропарин кальция) в дозе 0,3-0,4 мл, (в зависимости от массы тела) с последующим введением этого же препарата и в послеоперационном периоде. Для дренирования раны в груше сравнения использовались пхв дренажи диаметром 0,5 см, без возможности реинфузии аутокрови.
Критерии включения в исследование: отсутствие противопоказаний для применения Фраксипар Прадаксы и транексановой кислоты. Критерии исключения: декомпенсированная патология со стороны систем дыхания, кровообращения, нервной системы, хроническая почечно-печеночноя недостаточность, прием пациентами менее чем за 7 дней до операции дезагрегантов, или нестероидных противовоспалительных препаратов. В обеих группах исследовали показатели АЧТВ, фибриногена, РФМК, тромбоцитов. Кровопотерю интра- ж послеоперационную оценивали в течение первых суток после операции. Инфузионная терапия во время операции и в послеоперационном периоде проводилась по общепринятым стандартам.
Полученные количественные данные обрабатывали вариационно-статистическими методами с применением факторного и корреляционного анализов с использованием пакета прикладных программ «Statistica-6 Достоверность различий величин проводили по критериям Стьюдента и Фишера.
Результаты исследования и их обсуждение. Все пациенты до операции, проходили стандартное об следование и находились в состоянии компенсации физиологических функций, хотя многие из них имели ее путствующие заболевания: ИБС, артериальная гипертензия, сахарный диабет, ХОБЛ и др. Исходные лабораторные показатели у пациентов всех групп соответствовали возрастной норме. Не отмечено анемии, отклонений в показателях белой крови, случаев тромбоцитопении и тромбоцитоза. Статистически достоверных о: чий между исходными средними значениями соответствующего показателя в разных группах не выявлено. Таким образом, группы наблюдения и сравнения были идентичны по исходным лабораторным показателям. Опе рации эндопротезирования суставов в обеих группах проводились по стандартным методикам. Применялись сертифицированные импланты тазобедренного, коленного, локтевого и плечевого суставов бесцементной, цементной и гибридной фиксации. Объем кровопотери в группах наблюдения и сравнения представлен на графике 1.
График 1. Средняя кровопотеря при эндопротезировании суставов в зависимости от лечебной тактики
Из его анализа видно, что наибольшая кровопотеря отмечалась при тотальном эндопротезировании коленной: сустава (ТЭКС). В группе наблюдения она составила 565,2 ± 77,9 мл, в группе сравнения - 992,8 ± 84,3 мл. При тотальном эндопротезировании тазобедренного сустава (ТЭТБС), общая кровопотеря составила в группе наблюдения 533,6 ± 64,1 мл, в группе сравнения - 975,8 ± 80,9 мл. При эндопротезировании плечевого сустава (ТЭПС) кровопотеря составила в группах наблюдения и сравнения по 317,7 ± 45,7 мл и 554,9 ± 67,3 мл. Операция эндопротезирования локтевого сустава (ТЭПС) сопровождалась общей кровопотерей по 354,2 ± 55,2 мл ■ 614,4 ± 79,2 мл соответственно. Таким образом, при замене различных суставов интраоперационная кровопотеря в группе наблюдения была меньше, чем в группе сравнения в 1,5-1,8 раза, послеоперационная кровопотерж снизилась в 1,7-2,1 раза, а общая кровопотеря в группе наблюдения уменьшилась в 1,6-2,0 раза. Кроме тоге для оценки тяжести послеоперационной анемии оценивались показатели гемоглобина и эритроцитов до операции и на 5-7 сут. после операции. Установлено, что содержание гемоглобина на 7 сутки после операции в основной группе составили 129,3 ± 7,7 г/л (в группе сравнения - 107 ± 9,1 г/л), до операции этот показатель составил соответственно 147 ± 8,3 г/л и 144 ± 8,2 в изучаемых группах. Количество эритроцитов в эти же сроки соответственно 4,3x1010 в основной группе, и в группе сравнения - 3,4x1010 . Перед операцией количество эритроцитов в группах составило 4,9х1010 и 4,7х1010 в этих же группах соответственно.
При анализе количества и степени тяжести тромбэмболических осложнений в группах наблюдения и сравнения установлено, что фатальная ТЭЛА имела место у 1 больного в группе наблюдения (1,25 %), при эндопротезировании тазобедренного сустава и у 1 больного в группе сравнения (1,25 %), также при эндопротезировании тазобедренного сустава. Однако, при проведении ультразвукового дуплексного сканирования вес нижних конечностей на 5-7 сутки после операции, при отсутствии или минимальных клинических проявлениях, выявлены признаки флеботромбозов различной степени тяжести у И больных (13,7 %) в группе наблюдения, а в группе сравнения у 13 больных (16,2 %). Последнее потребовало коррекции лечебной тактики, однако на общий исход лечения не повлияло.
Для анализа состояния системы гемостаза исследовались показатели АЧТВ (активированное частичное тромбопластиновое время), фибриногена, РФМК (растворимый фибрин мономерный комплекс) и общее количество тромбоцитов (табл. 1). Анализируя данные таблицы 1, установлено, что в послеоперационном периоде в обеих группах, при различных видах артропластики наблюдалось снижение факторов системы гемокоагуляции, которое характерно для послеоперационной кровопотери легкой и средней степени и назначении антикоагу-лянтных препаратов. При этом изменение показателей системы гемостаза было в пределах физиологической нормы. Показатели уровня фибриногена, АЧТВ, РФМК и общего количества тромбоцитов в группах наблюдения и сравнения не имели статистической достоверности (р < 0,005).
| Показатели | группа сравнения | группа наблюдения | |||||||
| I | II | III | IV | I | II | III | IV | ||
| АЧТВ, сек | до опер | 23,1±2,2 | 25,2±2,6 | 24,2±2,1 | 23,7±2,0 | 22,4±2,0 | 24,8±2,2 | 25,3±2,4 | 24,5±2,5 |
| 3 сут | 37,1±3,6 | 35,2±3,4 | 34,6±3,3 | 35,6±0,2 | 36,7±3,4 | 34,6±2,5 | 35,7±2,7 | 33,4±3,0 | |
| Фибриноген, г/л | до опер | 3,2±0,2 | 3,0±0,2 | 3,3±0,3 | 3,4±0,4 | 3,4±0,2 | 2,9±0,3 | 3,6±0,4 | 3,9±0,4 |
| Зсут | 3,4±0,3 | 3,1 ±0,2 | 3,5±0,4 | 3,2±0,3 | 3,3±0,2 | 3,0±0,2 | 3,4±0,3 | 3,4±0,3 | |
| РФМК, мг% | до опер | 7.4±0.7 | 7,1±0.5 | 7.2±0.7 | 7,0±0.7 | 7,2±0.6 | 7,0±0.5 | 7.2±0.4 | 7.2±0.4 |
| 3 сут | 7.5±0.8 | 7.3±0.8 | 7,3±0.6 | 7,2±0.8 | 7.3±0.4 | 7.4±0.5 | 7.1±0.7 | 7,7±0.7 | |
| Тромбоциты, 10А9/л | до опер | 234±25 | 241±19 | 238±20 | 252±23 | 241±29 | 242±24 | 260±22 | 254±25 |
| 3 сут | 178±15 | 182=18 | 174±15 | 188±19 | 219±25 | 210±20 | 199±21 | 236±22 | |
В группе наблюдения всем больным поводилось дренирование раны специальной системой CellTrans с возможностью последующей реинфузии аутокрови (рис. 1). В группе сравнения использовались пхв дренажи диаметром 0,5 см, без возможности реинфузии аутокрови.
Рис. 1. Система для активного дренирования раны и реинфузии аутокрови (пояснения в тексте)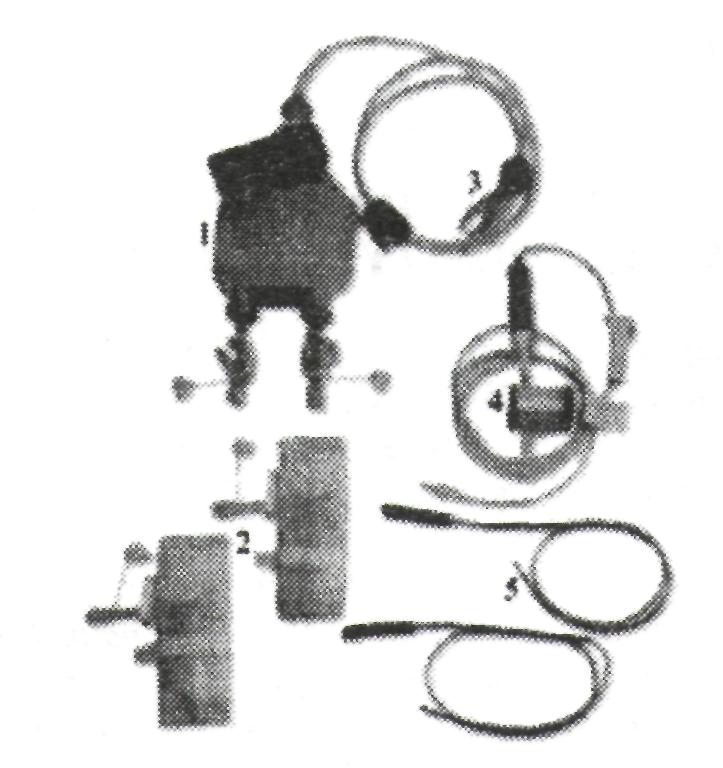
Принципиальной особенностью системы CellTrans является возможность адекватного активного дренирования раны после эндопротезирования, фильтация аутокрови 2-х ступенчатым фильтром (антитромботиче-ский и антилипидный), реинфузия практически всей собранной аутокрови. Система состоит из вакуумного дренажного сифона (1); 2-х пластиковых мешков по 600 мл, для сбора крови (2); разъема для подключения к дренажам (3); фильтра Pall Lipiguard (4); 2-х полиуретановых дренажей с троакарами (5). Объем реинфузии аутокрови составил в среднем 184,7 ± 39,4 мл. Дренажи удаляли в сроки от 12 до 24 часов после операции (при установившемся гемостазе).
Таким образом, несмотря на исходно высокий риск тромбоэмболических осложнений и повышенной кровопотери у больных после эндопротезирования крупных суставов, комплексная профилактика дает положительный эффект. Так, применение орального антикоагуляна Прадаксы в сочетании ингибитором фибринолиза транексамовой кислотой, а также адекватное дренирование раны системой CellTrans с возможностью реинфу-зии аутокрови позволяет уменьшить объем интра- и послеоперационной кровопотери в 1,4-2,0 раза, при минимальном риске тромбоэмболических осложнений.
Выводы
- Комплексное применение антикоагуляна Прадакса и ингибитора фибринолиза транексама до операции и в раннем послеоперационном периоде у больных с эндопротезирование крупных суставов целесобразно и безопасно.
- Совместное применение Прадаксы и транексама у больных с эндопротезированием крупных суетавов, при дренировании раны системой CellTrans с возможностью реинфузии аутокрови, снижает объем интра- и послеоперационной кровопотери при эндопротезировании крупных суставов в 1,4-2,0 раза.
- Комплексное применение препаратов Прадаксы и транексама, так же как и низкомолекулярного гепарина фраксипарина, в одинаковой степени способствуют снижению частоты тромбэмболических осложнений у больных с эндопротезированием крупных суставов.
Литература
- Бокарев, И. Н. Венозный тромбоэмболизм: лечение и профилактика / И. Н. Бокарев, Л. В. Попова, Т. Б. Кондратьева // Cons. Med. Хирургия. - 2005. - №7:1.
- Валетова, В. В. Нерешенные вопросы интраоперационной коррекции массивной кровопотери в неотложной хирургии / В. В. Валетова, В. X. Тимербаев, Е. Н. Кобзева и др. // Пленум правления Федерации анестезиологов и реаниматологов РФ: Науч. Тезисы. - Геленджик; 2011. - С. 28-30.
- Лазарев, А. Ф. Аргументы и факты медикаментозной тромбопрофилактики в оперативной травматологии и ортопедии / А. Ф. Лазарев // Вестник травматологии и ортопедии. - 2013. - № 3. - С. 36-42.
- Осипова, Н. А. Ингибиторы фибринолиза транексановая кислота и апротинин при радикальной простатэкто-мии: проспективное рандомизированное сравнительное исследование / Н. А. Осипова, Д. Р. Эльдарханов, В. Э. Хороненко и др // Анестезиол. и реаниматол. - 2012ю - №5 - С. 35-42.
- Прохоренко, В. М. Первичное и ревизионное эндопротезирование тазобедренного сустава / В. М. Прохоренко. - Новосибирск : Новосибирский НИИТО, 2007. - 345 с.
- Тихилов, Р. М. Руководство по эндопротезированию тазобедренного сустава /P.M. Тихилов, В. М. Шаповалов. - СПб., 2008. - 324 с.
- Шевченко, Ю. Л. (ред.). Диагностика и лечение тромбоза глубоких вен нижних конечностей / под ред. Ю. Л.Шевченко.-М, 2006.
- Hidalgo, M. Prophvlaxis of venous thromboembolism in abdominal wall surgery / M. Hidalgo // Hernia. - 2000. - 4:242-7.
- Llau J. V. Anesthesia fad surgical prophvlaxis of VTE Program Reuiew of the Venous Thromboembolic Disease 2007. -P. 212-34.
- Sharda, P. A Randomised controlled trail of the topical tranexamic acid total hip replacement / Sharda P., M. Vaghela, A. Shetty et al // Materials SICOT 2011, XXV Triennial World Congress. - Prague, Czech Republic, Abstract no.: 29164. - P. 630.
