Комплексная профилактика тромбоэмболий
Обследовано 160 пациентов, которым выполнено эндопротезирование тазобедренного, коленного, плечевого и локтевого суставов. В группе наблюдения (n = 80) за 30 мин до начала операции и через 4 ч после ее окончания вводился Транексам (транексамовая кислота) по 250 мг внутривенно. Через 10–12 ч после окончания операции (наступление устойчивого гемостаза) все пациенты этой группы получали ривароксабан (Ксарелто) в дозе 10 мг 1 раз в день. В группе сравнения (n = 80), которым за 12 ч до операции вводился фраксипарин, – подкожно 0,3–0,4 мл с последующим введением однократно в сутки в послеоперационном периоде. Определяли объем интраоперационной и послеоперационной кровопотери, а также динамику гематологических показателей. Оценивали общее количество тромбоэмболических осложнений. Кроме того, в группе наблюдения дренирование раны осуществлялось системой CellTrans с последующей реинфузией крови, а в группе сравнения дренирование раны выполнялось обычными ПХВ-дренажами с активной аспирацией содержимого без реинфузии крови. Установлено, что комплексное применение в раннем послеоперационном периоде транексамовой кислоты, ривароксабана, а также дренирование раны системами CellTrans с послеоперационной реинфузией крови позволило более чем на 40% сократить объем кровопотери на всех этапах исследования; общая кровопотеря составила в группе наблюдения 565,4 ± 123,1 мл, в группе сравнения – 951,8 ± 175,2 мл. Предложенный подход является эффективным и безопасным средством профилактики тромбоэмболических осложнений и кровотечений в раннем послеоперационном периоде после операций эндопротезирования крупных суставов.
Введение
Операции эндопротезирования крупных суставов относятся к сложным реконструктивным вмешательствам, которые позволяют эффективно восстанавливать нарушенные функции опорно-двигательного аппарата и заметно улучшать качество жизни пациентов [5, 6]. Однако, учитывая тяжесть данных операций, для них характерна высокая частота тромбоэмболических осложнений и других нарушений гемостаза. По данным разных авторов, тромбоэмболические осложнения при операциях эндопротезирования крупных суставов могут достигать 20%, общая кровопотеря составляет от 10 до 30% ОЦК, а при сложных и обширных вмешательствах может достигать 50% и более ОЦК [1, 3, 7, 8]. В связи со значитель ным увеличением числа операций эндопротезирования суставов необходимость профилактики тромбоэм болических осложнений и кровотечений в ранний послеоперационный период становится все более актуальной [2, 4, 9, 10].
Отсутствие единого комплексного подхода к методам профилактики тромбоэмболических осложнений и кровотечений при операциях эндопротезирования крупных суставов диктует необходимость проведения данного исследования.
Цель исследования
Цель исследования — оценить эффективность и безопасность комплексного подхода к профилактике тромбоэмболических осложнений и кровотечений при операциях эндопротезирования крупных суставов в раннем послеоперационном периоде.
Материалы и методы
В исследование включено 160 пациентов, лечившихся в ортопедическом отделении ОКБ г. Саратова в период 2010—2014 гг. Из них эндопротезирование тазобедренного сустава выполнено 42 пациентам, коленного сустава — 38, плечевого сустава — 39 и локтевого сустава — 41 больному. Возраст пациентов от 33 до 85 лет. Средний возраст 66,4 ± 7,5 года. Мужчин — 57, женщин — 103. Масса тела больных от 43,5 до 113 кг. Группу наблюдения (n = 80) составили пациенты, которым за 30 мин до начала операции и через 4 ч после ее окончания вводился ингибитор фибринолиза — ингибитор перехода плазминогена в плазмин — транексамовая кислота в дозе по 250 мг. Через 10—12 ч после окончания операции (наступление устойчивого гемостаза) все пациенты этой группы получали антикоагулянт прямого действия ривароксабан (Ксарелто) в дозе 10 мг/сут, который является высокоселективным прямым ингибитором фактора Ха, с последующим его применением в этой же дозировке 1 раз в сутки до 2 нед. после операции. В группе наблюдения всем больным проводилось дренирование раны специальной системой CellTrans с возможностью последующей реинфузии аутокрови. В группу сравнения (n = 80) вошли пациенты, которым за 12 ч до операции и через 12 ч после операции вводился антикоагулянт прямого действия фраксипарин (надропарин кальция) в дозе 0,3–0,4 мл (в зависимости от массы тела) с последующим введением этого же препарата и в послеоперационном периоде. Транексамовая кислота в группе сравнения вводилась по той же схеме, что и в основной группе. Для дренирования раны в группе сравнения использовались ПХВ-дренажи диаметром 0,5 см без возможности реинфузии аутокрови.
Критерии включения в исследование: отсутствие противопоказаний для применения фраксипарина, ривароксабана и транексамовой кислоты. Критерии исключения: декомпенсированная патология со стороны систем дыхания, кровообращения, нервной системы, хроническая почечно-печеночная недостаточность, прием пациентами менее чем за 7 дней до операции антиагрегантов или нестероидных противовоспалительных препаратов. В обеих группах исследовали показатели АЧТВ, фибриногена, РФМК, тромбоцитов. Кровопотерю интра- и послеоперационную оценивали в течение первых суток после операции. Инфузионная терапия во время операции и в послеоперационном периоде проводилась по общепринятым стандартам.
Рисунок 1. Средняя кровопотеря при эндопротезировании суставов в зависимости от лечебной тактики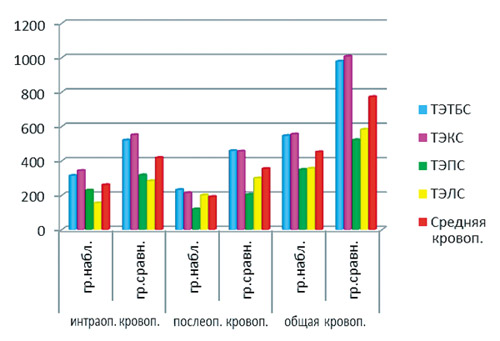
Полученные количественные данные обрабатывали вариационно-статистическими методами с применением факторного и корреляционного анализов с использованием пакета прикладных программ Statistica-6. Достоверность различий величин проводили по критериям Стьюдента и Фишера.
Результаты исследования и их обсуждение
Все пациенты до операции проходили стандартное обследование и находились в состоянии компенсации физиологических функций, хотя многие из них имели сопутствующие заболевания: ИБС, артериальную гипертензию, сахарный диабет, ХОБЛ и др. Исходные лабораторные показатели у пациентов всех групп соответствовали возрастной норме. Не отмечено анемии, отклонений в показателях белой крови, случаев тромбоцитопении и тромбоцитоза. Статистически достоверных отличий между исходными средними значениями соответствующего показателя в разных группах не выявлено. Таким образом, группы наблюдения и сравнения были идентичны по исходным лабораторным показателям. Операции эндопротезирования суставов в обеих группах проводились по стандартным методикам. Применялись сертифицированные имплан таты тазобедренного, коленного, локтевого и плечевого суставов бесцементной, цементной и гибридной фиксации.
Объем кровопотери в группах наблюдения и сравнения представлен на рисунке 1. Из его анализа видно, что наибольшая кровопотеря отмечалась при тотальном эндопротезировании коленного сустава (ТЭКС). В группе наблюдения она составила 551,2 ± 75,8 мл, в группе сравнения — 1 006,5 ± 85,9 мл. При тотальном эндопротезировании тазобедренного сустава (ТЭТБС) общая кровопотеря составила в группе наблюдения 546,3 ± 62,2 мл, в группе срав нения — 978,4 ± 82,3 мл. При эндопротезировании плечевого сустава (ТЭПС) кровопотеря составила в группах наблюдения и сравнения по 348,9 ± 44,9 и 521,6 ± 68,2 мл соответственно. Операция эндопротезирования локтевого сустава (ТЭЛС) сопровождалась общей кровопотерей по 355,8 ± 54,1 и 582,3 ± 73,6 мл соответственно. Таким образом, при замене различных суставов интраоперационная кровопотеря в группе наблюдения была меньше, чем в группе сравнения в 1,4—1,8 раза, послеоперационная кровопотеря снизилась в 1,4—2,1 раза, а общая кровопотеря в группе наблюдения уменьшилась в 1,7—1,8 раза. Кроме того, для оценки тяжести послеоперационной анемии оценивались показатели гемоглобина и эритроцитов до операции и на 5–7-е сут. после операции. Установлено, что содержание гемоглобина на 7-е сут. после операции в основной группе составило 132,3 ± 7,9 г/л (в группе сравнения – 104 ± 9,2 г/л), до операции этот показатель составил 149 ± 8,5 и 145 ± 8,4 г/л в изучаемых группах. Количество эритроцитов в эти же сроки составило 4,2 х 1012 в основной группе и 3,2 х 1012 в группе сравнения. Перед операцией количество эритроцитов в группах соста вило 4,9 х 1012 и 4,8 х 1012 в этих же группах соответственно.
При анализе количества и степени тяжести тромбоэмболических осложнений в группах наблюдения и сравнения установлено, что фатальная ТЭЛА имела место у 1 больного в группе наблюдения (1,25%) при эндопротезировании тазобедренного сустава и у 1 больного в группе сравнения (1,25%) также при эндопротезировании тазобедренного сустава. Однако при проведении ультразвукового дуплексного сканирования вен нижних конечностей на 5—7-е сут. после операции при отсутствии или минимальных клинических проявлениях (незначительные боли и отеки на стопах и голенях) выявлены признаки флеботромбозов легкой и средней степени тяжести у 9 больных (11,25%) в группе наблюдения, а в группе сравнения — у 10 больных (12,5%). При дуплексном сканировании у этих больных выявлялись пристеночные плоскостные нефлотирующие тромбы шириной не более _ диаметра вены без нарушения кровотока по сосуду. Последнее потребовало коррекции лечебной тактики, но на общий исход лечения не повлияло.
Рисунок 2. Система для активного дренирования раны и реинфузии аутокрови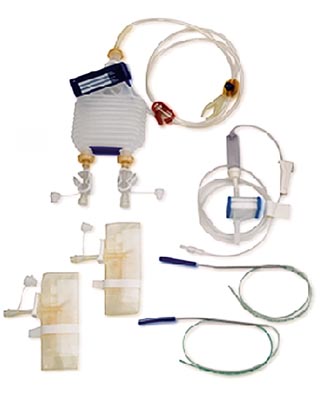
Для анализа состояния системы гемостаза исследовались показатели АЧТВ (активированное частичное тромбопластиновое время), фибриногена, РФМК (растворимый фибрин-мономерный комплекс) и общее количество тромбоцитов (табл. 1). В таблице 1 видим, что в послеоперационном периоде в обеих группах при различных видах артропластики наблюдалось снижение факторов системы гемокоагуляции, которое характерно для послеоперационной кровопотери легкой и средней степени, и назначались антикоагулянтные препараты. При этом изменение показателей системы гемостаза бы ло в пределах физиологической нормы. Показатели уровня фибриногена, АЧТВ, РФМК и общего количества тромбоцитов в группах наблюдения и сравнения не имели статистической достоверности (р ≤ 0,005).
| Показатели | Группа сравнения | Группа наблюдения | |||||||
| I | II | III | IV | I | II | III | IV | ||
| АЧТВ, с | До операции | 25,2 ± 2,1 | 25,1 ± 2,4 | 24,3 ± 2,1 | 23,3 ± 2,1 | 24,3 ± 2,1 | 24,5 ± 2,3 | 24,9 ± 2,5 | 25,5 ± 2,3 |
| 3-и сут. | 35,4 ± 3,3 | 34,1 ± 3,3 | 35,6 ± 3,1 | 36,0 ± 2,2 | 36,2 ± 3,4 | 35,1 ± 2,5 | 35,4 ± 2,7 | 34,9 ± 2,9 | |
| Фибриноген, г/л | До операции | 3,1 ± 0,3 | 3,2 ± 0,3 | 3,3 ± 0,3 | 3,2 ± 0,2 | 3,4 ± 0,2 | 3,1 ± 0,3 | 3,4 ± 0,4 | 3,5 ± 0,5 |
| 3-и сут. | 3,4 ± 0,2 | 3,3 ± 0,3 | 3,5 ± 0,3 | 3,2 ± 0,3 | 3,4 ± 0,3 | 3,2 ± 0,3 | 3,4 ± 0,3 | 3,4 ± 0,4 | |
| РФМК, мг, % | До операции | 7,4 ± 0,7 | 7,3 ± 0,5 | 7,4 ± 0,6 | 7,3 ± 0,6 | 7,2 ± 0,6 | 7,3 ± 0,5 | 7,4 ± 0,4 | 7,4 ± 0,5 |
| 3-и сут. | 7,5 ± 0,6 | 7,3 ± 0,5 | 7,3 ± 0,6 | 7,4 ± 0,8 | 7,4 ± 0,5 | 7,5 ± 0,5 | 7,4 ± 0,6 | 7,6 ± 0,7 | |
| Тромбоциты, 10^9/л | До операции | 231 ± 24 | 242 ± 25 | 238 ± 21 | 244 ± 26 | 240 ± 27 | 242 ± 26 | 249 ± 23 | 251 ± 26 |
| 3-и сут. | 181 ± 16 | 193 ± 20 | 191 ± 19 | 190 ± 19 | 211 ± 22 | 218 ± 20 | 192 ± 19 | 198 ± 23 | |
В группе наблюдения всем больным поводилось дренирование раны специальной системой CellTrans с возможностью последующей реинфузии аутокрови (рис. 2). В группе сравнения использовались ПХВ-дренажи диаметром 0,5 см без возможности реинфузии аутокрови. Принципиальной особенностью системы CellTrans является возможность адекватного активного дренирования раны после эндопротезирования, фильтрация аутокрови 2-ступенчатым фильтром (антитромботический и антилипидный), реинфузия практически всей собранной аутокрови. Система состоит из вакуумного дренажного сифона (1); 2 пластиковых мешков по 600 мл для сбора крови (2); разъема для подключения к дренажам (3); фильтра Pall Lipiguard (4); 2 полиуретановых дренажей с троакарами (5). Объем реинфузии аутокрови составил в среднем 184,7 ± 39,4 мл. Дренажи удаляли в сроки от 12 до 24 ч после операции (при установившемся гемостазе).
Таким образом, несмотря на исходно высокий риск тромбоэмболических осложнений и повышенной кровопотери у больных после эндопротезирования крупных суставов, комплексная профилактика дает положительный эффект. Так, применение перорального антикоагулянта ривароксабана (Ксарелто) в сочетании с ингибитором фибринолиза транексамовой кислотой, а также адекват ное дренирование раны системой CellTrans с возможностью реинфузии аутокрови позволяет уменьшить объем интра- и послеоперационной кровопотери в 1,8—1,9 раза при минимальном риске тромбоэмболических осложнений.
Выводы
- Комплексное применение перорального антикоагулянта ривароксабана (Ксарелто) и ингибитора фибринолиза транексамовой кислоты до операции и в раннем послеоперационном периоде у больных с эндопротезированием крупных суставов целесообразно и безопасно.
- Совместное применение ривароксабана и транексамовой кислоты у больных с эндопротезированием крупных суставов при дренировании раны системой CellTrans с возможностью реинфузии аутокрови снижает объем интра- и послеоперационной кровопотери при эндопротезировании крупных суставов в 1,8–1,9 раза.
- Комплексное применение препаратов ривароксабана и транексамовой кислоты, так же как и низкомолекулярного гепарина фраксипарина, в одинаковой степени способствует снижению частоты тромбоэмболических осложнений у больных с эндопротезированием крупных суставов.
Литература
- Бокарев И.Н., Попова Л.В., Кондратьева Т.Б. Венозный тромбоэмболизм: лечение и профилактика. Cons. Med. Хирургия, 2005, 7: 1.
- Валетова В.В., Тимербаев В.Х., Кобзева Е.Н. и др. Нерешенные вопросы интраоперационной коррекции массивной кровопотери в неотложной хирургии. В кн.: Пленум правления Федерации анестезиологов и реаниматологов РФ: науч. тезисы. Геленджик, 2011: 28–30.
- Лазарев А.Ф. Аргументы и факты медикаментозной тромбопрофилактики в оперативной травматологии и ортопедии. Вестник травматологии и ортопедии, 2013, 3: 36–42.
- Осипова Н.А., Эльдарханов Д.Р., Хороненко В.Э. и др. Ингибиторы фибринолиза транексановая кислота и апротинин при радикальной простатэктомии: проспективное рандомизированное сравнительное исследование. Анестезиол. и реаниматол., 2012, 5: 35–42.
- Прохоренко В.М. Первичное и ревизионное эндопротезирование тазобедренного сустава. Новосибирский НИИТО, 2007.
- Тихилов Р.М., Шаповалов В.М. Руководство по эндопротезированию тазобедренного сустава. СПб., 2008.
- Шевченко Ю.Л. (ред.). Диагностика и лечение тромбоза глубоких вен нижних конечностей. М., 2006.
- Hidalgo M. Prophvlaxis of venous tbromboembolism in аbdominal wall surgery. Hernia, 2000, 4: 242–7.
- Llau JV. Anesthesia fnd surgical prophvlaxis of VTE Program Reuiew of the Venous Thromboembolic Disease. 2007: 212–34.
- Sharda P, Vaghela M, Shetty A, Nargol A, Alshryda S. A Randomised controlled trail of the topical tranexamic acid total hip replacement. Materials SICOT 2011, XXV Triennial World Congress, Prague, Czech Republic, Abstract no.: 29164. P. 630.
